W trosce o przyszłe zapotrzebowanie energetyczne zaczęliśmy wykorzystywać odnawialne źródła energii, staramy się także o bardziej efektywne i „czystsze” wykorzystanie nieodnawialnych źródeł energii. Odpowiedzią na nasze przyszłe zapotrzebowanie energetyczne może być także wykorzystanie alternatywnych paliw takich jak wodór.
Zwolennicy wykorzystania wodoru jako paliwa przyszłości uważają, iż spełnia on większość wymagań stawianych dobrym systemom energetycznym.
Idealny system energetyczny
- powinien opierać się o lokalne zasoby energetyczne;
- powinien być w stanie korzystać z wielu źródeł energii;
- powinna ograniczać emisję gazów cieplarnianych i szkodliwych zanieczyszczeń;
- powinien być wydajny energetycznie (czyli powinien osiągać wysoki poziom energii wyjściowej w porównaniu z użytą energią wejściową);
- powinien być dostępny (łatwy do znalezienia, wyprodukowania lub ujarzmienia);
- powinien zapewniać stabilne ceny energii.
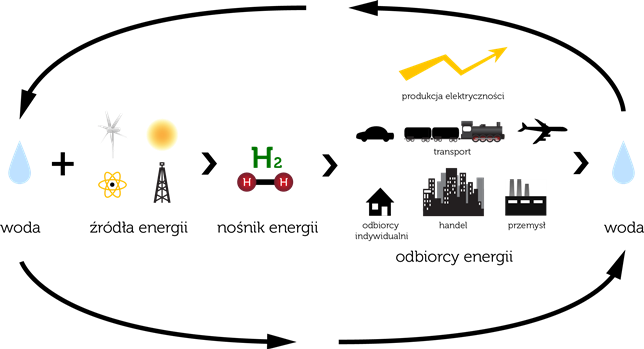
System energetyczny oparty na wodorze
Wodór
Według definicji: Wodór (H, łac. hydrogenium) – pierwiastek chemiczny o liczbie atomowej 1, niemetal z bloku s układu okresowego.


Wodór jest substancją łatwopalną, tworzy mieszaniny wybuchowe. Jego wysokie stężenie może wywoływać w organizmie ludzkim asfiksje czyli stan niedoboru tlenowego. Kontakt ciekłego wodoru ze skórą zakończy się poparzeniem.
Wodór atomowy
Wodór atomowy w przeciwieństwie do wodoru cząsteczkowego jest odmianą tworzoną przez pojedyncze atomy. Wodór atomowy jest nietrwały i szybko łączy się z drugim atomem wodoru, tworząc cząsteczkę H2, czyli wodór cząsteczkowy (molekularny).
Wodór cząsteczkowy
Wodór cząsteczkowy (wodór dwuatomowy, wodór molekularny) (H2) składa się z dwóch atomów wodoru. Występuje w dwóch odmianach o nieco innych właściwościach fizycznych (ortowodór i parawodór). Naturalny wodór molekularny w temperaturze pokojowej stanowi mieszaninę obu odmian (ok. 75% ortowodoru i 25% parawodoru).
Izotopy wodoru
Wodór jest jedynym pierwiastkiem, którego izotopy (naturalne) mają swoje własne nazwy. Wodór występujący na Ziemi jest mieszaniną trzech izotopów. Pierwszy z nich: Prot, którego jądro składa się z jednego protonu, stanowi większość wodoru występującego naturalnie. Izotop deuter posiada jądro złożone z protonu i neutronu. Tryt, składa się z jednego protonu i dwóch neutronów.

Izotop
Izotopami nazywamy atomy tego samego pierwiastka różniące się masą atomową. Izotopy mają tę samą ilość protonów w jądrach i różną liczbę neutronów. Pojedyncze pierwiastki (np. fluor, złoto i magnez) nie posiada izotopów. Wiele pierwiastków posiada grupę izotopów stabilnych, inne natomiast mają jeden lub kilka izotopów radioaktywnych, radioizotopów. Radioizotopy cechuje regularna szybkość rozpadu (okres połowicznego rozpadu) mogą być więc wykorzystywane jako swoisty rodzaj zegara. W taki sposób wykorzystywany jest np. izotop węgla 14C.
|
Występowanie wodoru
Jest to pierwiastek powszechnie występujący we Wszechświecie. W postaci wolnej występuje w gwiazdach i obłokach międzygwiazdowych. Wchodzi także w skład wielu związków nieorganicznych.
Wodór jest także źródłem energii jaką otrzymujemy od słońca. Słońce jest kulą zjonizowanego gazu składającego się z 74% wodoru i 25% helu (na pozostały 1% składają się pierwiastki cięższe i proste związki chemiczne). 99% energii wytwarzana jest w procesie łączenia się (fuzji) 4 protonów w jądro helu. Proces ten zachodzi głównie w drodze szeregu reakcji tworzących cykl protonowo-protonowy (pp).
Promieniowanie słoneczne widzimy jako światło oraz odczuwamy jako ciepło na powierzchni naszej planety. Słońce ma wpływ na powstawanie wiatrów, opady deszczu, czy procesy fotosyntezy. Energia słoneczna jest także wykorzystywana bezpośrednio jako odnawialne źródło energii.
Na ziemi wodór występuje w formie związanej. W połączeniu z tlenem jako cząsteczka wody(H2O), w związkach węglowodorów, w połączeniu z węglem jako cząsteczka metanu (CH4). Wodór powstawać może także z biomasy. W postaci cząsteczkowej występuje także w górnej warstwie atmosfery (0,9%).

|
Za pierwszego „wytwórcę” wodoru uchodzi lekarz i przyrodnik T. von Hohenheim (znany także jako T. Paracelsusi). Prowadząc eksperymenty polegające na wrzucaniu metali do kwasów i zbieraniu do naczyń produktów tych reakcji, działając kwasem na żelazo zauważył wydzielanie się nieznanego gazu. Ponieważ gaz ten palił się nazwał go „palnym powietrzem”. R. Boyle w 1660 r. powtórzył eksperyment, zastosował kwas siarkowy H2SO4, i stwierdził, że wydzielający się gaz przestaje się palić w rozrzedzonym powietrzu. Opisał wybuchową naturę mieszanki wodoru z powietrzem, zwanej dziś mieszaniną piorunującą, a wówczas aria tonante – z włoskiego – "powietrze grzmiące". W 1776 r. H. Cavendish wykazał, że rozważany gaz jest substancją prostą lżejszą od powietrza, a w 1781 r. udowodnił, że produktem spalania jest woda. Nie skojarzył jednak, że jest on składnikiem wody. Substancję uznano za pierwiastek dzięki A. L. Lavoisier, prowadzącemu badania nad otrzymaniem wody z wodoru i tlenu. Lavoisier nadał mu nazwę „hydrogene” (łac. hydrogenium — tworzący wodę).

|
 |
 |
 |
| T. Paracelsus |
R. Boyle |
H. Cavendish |
A. L. Lavoisie |
|
Zastosowanie wodoru
Wodór stosowano do napełniania balonów i sterowców obecnie zastąpiono go helem. Wodór jest używany do syntezy produktów przemysłu chemicznego - amoniaku, chlorowodoru, metanolu i benzyny syntetycznej, w procesach redukcji (np. tlenków metali) i uwodorniania (utwardzania) tłuszczów. Stosowany w palnikach tlenowodorowych umożliwia uzyskiwanie wysokich temperatur. Skroplony wodór znalazł zastosowanie jako paliwo w silnikach rakietowych. Wodór stosowany jest jako paliwo dla silników o spalaniu wewnętrznym. Wykorzystywany jest także w ogniwach paliwowych do generowania prądu elektrycznego. Wodór wykorzystywany jest także w elektrowniach do chłodzenia generatorów dużej mocy.

Silnik rakietowy testowany w NASA - spalany wodór z tlenem, tworzy przy pełnym ciągu niemal niewidoczny płomień.
Izotop wodoru – tryt – wykorzystywany jest w reakcjach termojądrowych, które mogą stanowić źródło taniej energii.
Izotop – deuter – wykorzystywany jest jako spowalniacz w reaktorach atomowych. Związki zawierające deuter są wykorzystywane do przygotowanie próbek NMR ze względu na właściwości fizykochemiczne tego atomu.
Wodór jako paliwo
Wodór może być wykorzystywany jako bezpośrednie źródło energii lub jako alternatywny sposób magazynowania energii uzyskanej z innych źródeł (na przykład energii wiatru, słońca).
Powszechność występowania w przyrodzie, niewyczerpywalne zasoby mórz i oceanów przemawiają za tym, że wodór jest najbardziej proekologicznym paliwem. Przeszkodą w jego stosowaniu, jest jak na razie, nieopłacalność produkcji, której koszty są wyższe niż energia uzyskana ze spalenia wodoru.
Zalety wodoru jako paliwa
- jest proekologiczny – produktem spalania jest woda;
-
ma małą energię inicjacji zapłonu (jego spalanie jest sprawniejsze);
-
jest łatwiejszy i tańszy w magazynowaniu niż energia elektryczna (co nie znaczy, że magazynowanie jest łatwe);
-
jego zapasy są praktycznie niewyczerpane.
Wady wodoru:
- tworzy z powietrzem mieszaninę wybuchową;
- dyfunduje przez metale;
- podczas spalania w powietrzu tworzą się tlenki azotu (NOx); (powstają one także podczas spalania innych paliw).
Instalacje przemysłowe produkujące wodór najczęściej są łączone z instalacjami do wykorzystania wodoru, ponieważ istnieje problem z jego przechowywaniem i transportem. Problem ten jest istotnym ograniczeniem w zastosowaniu wodoru jako paliwa samochodowego.
Pierwsza i ostatnia wada nie występuje podczas bezpłomieniowego spalania wodoru w ogniwach paliwowych, w których produktem spalania jest woda i prąd elektryczny.
Wodór wytwarzany może być na wiele sposobów jednak z przyczyn proekologicznych zależy nam na pozyskiwaniu wodoru z „czystych” źródeł energii.